近日,我校药学院陈敬华教授团队在生物制造融合蛋白构建智能化递药系统的研究方面取得重要进展,研究成果以“Bioengineered Human Serum Albumin Fusion Protein as Target/Enzyme/pH Three-Stage Propulsive Drug Vehicle for Tumor Therapy”为题在《ACS Nano》上在线发表(https://doi.org/10.1021/acsnano.0c07610)。
近年来,利用人体自有的蛋白、多糖、脂质等物质构建功能性递药系统引起了研究者的广泛关注。其中,人血清白蛋白(HSA)因其生物可降解、体内长循环和肿瘤靶向性等优点,已成功开发为紫杉醇白蛋白纳米粒(Abraxane)用于临床肿瘤治疗。然而,Abraxane仍存在靶向性不足、肿瘤组织穿透性弱、释药不可控等缺点。很多研究尝试通过化学修饰法改善以上不足,但化学反应条件苛刻,分离纯化困难,并可能影响HSA的构象,无法实现产业化应用。
研究人员通过基因工程技术将编码多聚组氨酸、基质金属酶切序列和肿瘤靶向肽的基因与HSA基因进行重组,构建了多功能白蛋白融合蛋白。该融合蛋白中可通过多聚组氨酸的亲水-疏水转换作用,自组装制备载抗肿瘤药物紫杉醇的纳米粒。该纳米粒在保持Abraxane优点的基础上,赋予了肿瘤部位靶向蓄积、核壳分离促进摄取、胞内敏感释药的“三级推进”功能,体内外实验均表现出更优的抗肿瘤效果。该研究提出了一种新的生物制造智能化药物载体的策略,在抗肿瘤药物精准递送方面具有广泛的应用前景,已获批国际发明专利。
陈敬华教授和周娟副研究员为该论文的共同通讯作者,江南大学17级博士生王明宇为该论文的第一作者。上述研究工作得到了国家自然科学基金(批准号21574059),江苏省自然科学基金(批准号BK20170203),中国博士后研究基金会(批准号2019M660166)和国家轻工业技术与工程一流学科计划(授权号LITE2018-20)的资助。
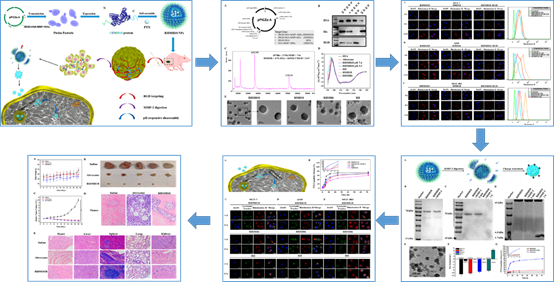
基于生物工程技术的人血清白蛋白融合蛋白的制备及其在肿瘤靶向治疗中的应用


