近期,我校best365体育官网平台周志教授课题组在新型人工酶设计与创制方面取得了重要进展,研究成果“Design and Evolution of an Enzyme for the Asymmetric Michael Addition of Cyclic Ketones to Nitroolefins by Enamine Catalysis”正式发表于国际化学顶刊《Angewandte Chemie International Edition》(IF=16.1)。论文第一作者为best365体育官网平台22级博士研究生朱致熹,通讯作者为best365体育官网平台周志教授。

绿色生物制造的核心是生物酶催化剂,然而天然酶的结构仅由20种天然氨基酸构成,这一有限的组成成分在很大程度上制约了其催化反应的类型与效率,从而限制了生物合成过程的多样性和可行性。面对这一挑战,创制具有新型功能的生物酶成为推动绿色生物制造技术进步的关键。
江南大学周志教授课题组致力于新型人工酶创制与催化研究,前期发展了基于非天然氨基酸的新型人工酶创制研究,开发了首例人工酶的协同催化体系(Nat. Catal.2020, 3, 289)。近期该课题组在Angewandte Chemie上发表文章报道了人工酶的最新研究进展(Angew. Chem. Int. Ed. 2024, e202404312),该研究报道了一种通过化学偶联法引入吡咯烷基团作为催化中心的新型人工酶的设计与创制。此种新设计的含仲胺催化中心的人工酶可通过烯胺催化模式活化酮类分子底物,高效催化环状酮分子与硝基烯烃的不对称迈克尔加成反应,合成具有两个手性中心的γ-硝基环酮产物,并具备优异的立体选择性(97% e.e.,>20:1d.r.),产率可达86%。这项工作为环状酮类分子的不对称合成提供了一种有效的生物催化策略,并展示了人工酶在扩展生物催化中非天然反应的巨大潜力。

图1.人工酶催化酮的不对称迈克尔加成反应
目前天然的以伯胺为催化中心的酶类活化能力有限,因此设计并构建烯胺催化模式下实现酮功能化的酶库将具有重要意义,但迄今为止报道非常少。本研究基于乳酸乳球菌多药耐药性调节剂(LmrR)蛋白骨架,通过吡咯烷二硫化物共价修饰半胱氨酸残基而高效引入酶催化中心(> 99%转化率)。作者设计环己酮与反式β-硝基苯乙烯的迈克尔加成反应作为模板反应,评价新设计的人工酶的催化潜力,该模板反应以LmrR_V15C处的吡咯烷共价修饰的人工酶起始,液相结果显示获得相应的迈克尔加成产物3a(2%的产率、3:1的d.r.和26%的e.e.)。
后续作者在LmrR的二聚体间疏水空腔中筛选近20个位点将其分别突变为半胱氨酸,后经二硫键共价修饰引入含有吡咯烷的催化残基,以此构建吡咯烷为催化中心的人工酶酶库。通过酶的理性设计和定向进化,优势人工酶突变体LmrR_L57C_N88A_THP展现出出色的催化效率与立体选择性,展开酶催化底物谱考察,发现进化变体对六元环状酮与各类取代芳基、杂环的硝基烯烃均显示出良好的耐受性,底物谱可拓展性强。酶促动力学研究显示进化变体kcat/KM约为野生型L57C_THP的3.7倍,TTN约为野生型4倍。
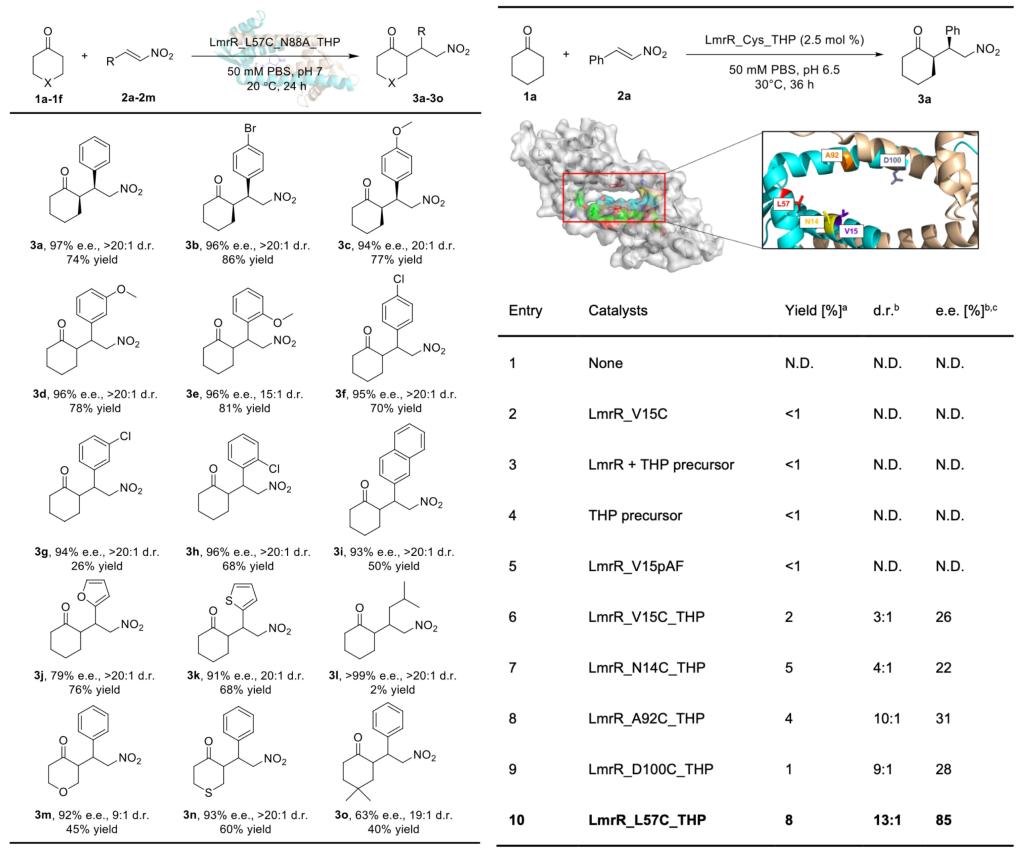
图2.研究论文数据图示
总之,江南大学周志课题组设计并开发了一种含有催化吡咯烷残基的新型人工酶,并证明了其作为不对称迈克尔反应的有效催化剂的潜力。LmrR_Cys_THP在生物催化的条件下以烯胺催化模式催化完成环状酮对硝基烯烃的不对称Michael反应,进化的变体可获得到产率高、立体选择性好的手性酮产物。这项工作不仅为环酮分子的不对称官能团化提供了一种高效的生物催化策略,并且展示了人工酶在发展不对称非天然生物转化应用中的重要潜力。
该研究工作工作得到了江南大学启动经费、科技部重点研发计划、国家自然科学基金、江苏省自然科学基金等项目的支持。
文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202404312
教授简介
周志博士,江南大学教授、博导,江苏特聘教授,主要从事新酶创制与催化研究。目前已在Nat. Chem., Nat. Catal., Angew. Chem., ACS Catal.等杂志发表一作/通讯论文多篇。实验室欢迎大家报考本课题组的博士和硕士研究生,详见课题组主页:https://www.x-mol.com/groups/zhouzhi



