近日,best365体育官网平台史劲松教授团队对难溶性亚单位疫苗在大肠杆菌表达体系中的可溶性表达问题上取得突破性进展,相关论文“Semiautomated design and soluble expression of a chimeric antigen TbpAB01 fromGlaesserella parasuis”正式发表在生物技术领域权威期刊《Biotechnology and Bioengineering》上。该论文致力于解决难溶性膜蛋白抗原在原核表达体系中的可溶性表达问题,以副猪嗜血杆菌铁转运系统的TbpA和TbpB两个膜蛋白作为疫苗靶点,开展可溶性多表位嵌合抗原(ChA)的半自动设计、ChA蛋白折叠元件的筛选、ChA的体外评价和ChA重组菌的发酵工艺优化等系统性研究。膜蛋白抗原表达的最高可溶性比例达到90%以上,蛋白产量最高值达到4.27 g/L,其产量和可溶性比例相比目前行业水平(<100mg/L,<50%)均取得显著提升。
1.基于结构的ChA TbpAB01的设计
副猪嗜血杆菌通常定植于猪的上呼吸道,导致格拉瑟氏疾病(GD),与肺炎、多关节炎和脑膜炎等症状相关。通过接种灭活全细胞疫苗虽然可以预防由GD导致的数百万感染群体死亡,但是由于副猪嗜血杆菌复杂多变血清型的存在,基于表面多糖的全细胞灭活疫苗不涵盖广泛的血清多样性,因此,开发广谱高效的副猪嗜血杆菌疫苗仍存在挑战。由副猪嗜血杆菌表面铁转运相关膜蛋白和副猪嗜血杆菌的外膜囊泡等制备的亚单位疫苗在猪攻毒实验中提供完全的保护,这表明这些亚单位疫苗候选物可能是开发副猪嗜血杆菌新型疫苗的重要靶点。在这里,一种新型的膜蛋白嵌合抗原设计工作流(DSGA)被开发用于发现和分析细菌表面蛋白的疫苗靶点,从而设计出多表位嵌合抗原候选物TbpAB01,该嵌合抗原可以在大肠杆菌中实现部分可溶性表达。
2.可溶性标签和折叠伴侣增强TbpAB01的可溶性比例
异源表位的插入可能会破坏可溶性蛋白支架的表面亲水性,特别是在大肠杆菌中过表达过程中会导致不可溶性包涵体的形成。本论文在大肠杆菌中系统筛选了12种助溶标签和4种内源性分子伴侣,结果显示P17、A18和ELK16三种助溶标签可以显著增强可溶性TbpAB01蛋白比例和蛋白产量,与分子伴侣共表达之后可以进一步改善TbpAB01蛋白可溶性比例(超过90%)。并且这种助溶标签的融合对该嵌合抗原的免疫原性和猪免疫阳性血清结合特性无显著影响。
3.基础培养基碳/氮源优化以恢复细胞生长和蛋白生产能力
虽然通过融合助溶标签和过表达分子伴侣显著改善嵌合抗原的可溶性表达水平,但是重组大肠杆菌的生长能力和蛋白表达能力受到代谢负担的抑制。为了改善重组大肠杆菌中嵌合抗原合成的能力,本论文通过优化基础培养基中的碳/氮源的类型和浓度改善了该嵌合抗原生产菌株的蛋白合成能力。相比于未优化之前的生物量和可溶性蛋白产量(OD600= 4.60,0.346 g/L),使用DM4-Try培养基的嵌合抗原生产菌株的最终生物量(OD600= 5.83,0.449 g/L)和可溶性蛋白滴度分别增加33%和30%。
4.嵌合抗原生产菌株的高细胞密度发酵
高密度细胞培养技术(High cell density cultivation, HCDC)是目前用于获得高蛋白产率的一种重要策略,通过改进工程菌的培养方式和发酵条件以提高菌体密度,最终提高产物的生产强度。最终的嵌合抗原生产菌株细胞干重和细胞密度分别为28.3 g/L和73.3,P17-TbpAB01可溶性蛋白产量在诱导30 h之后达到最高值4.27 g/L。与在摇瓶水平中的蛋白产量(0.449 g/L)相比,通过分批补料发酵策略P17-TbpAB01的可溶性蛋白滴度增加8.5倍,体积生产率(0.142 g/L/h)相比于摇瓶水平(0.037 g/L/h)也提高2.83倍。
best365体育官网平台2021级硕士生陈金平为论文第一作者,龚劲松教授为论文通讯作者。上述研究获得国家自然科学基金项目、国家重点研发计划以及中央高校基本科研业务费专项资金的资助。
文章链接:https://doi.org/10.1002/bit.28710
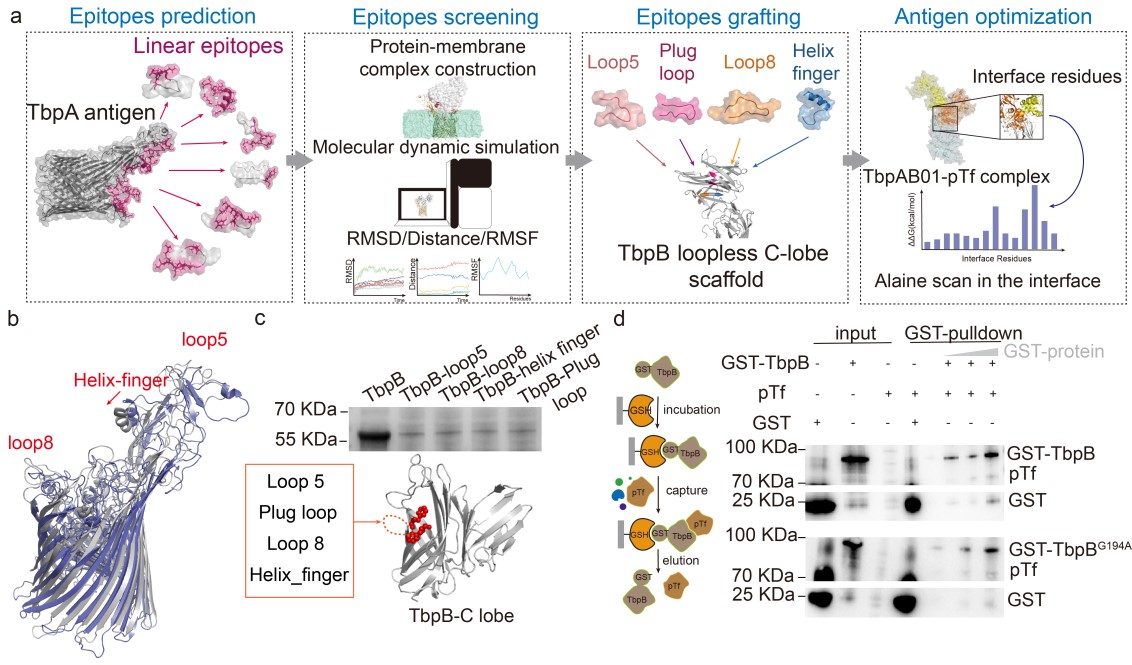
基于结构的ChA TbpAB01的设计
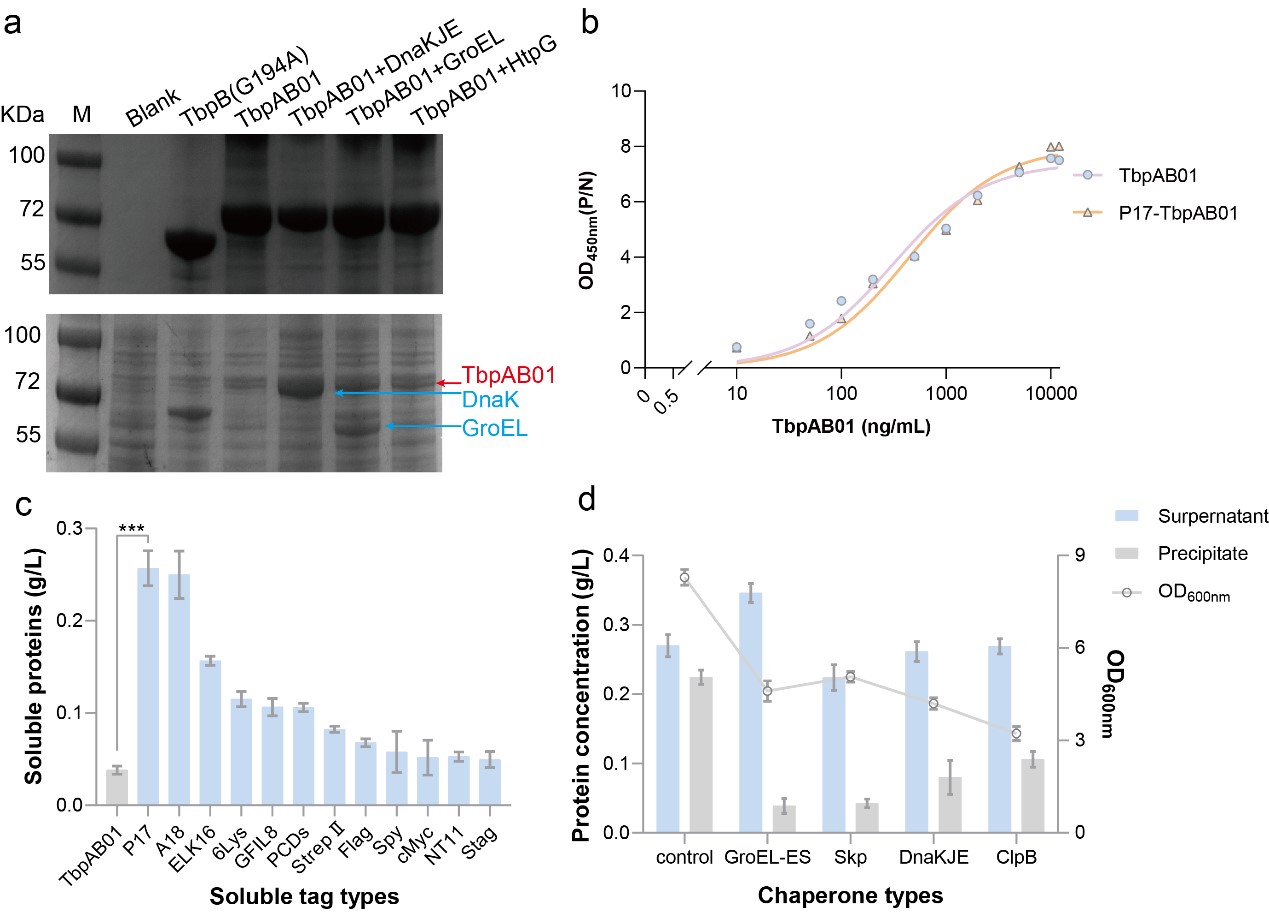
可溶性标签和折叠伴侣增强TbpAB01的可溶性比例
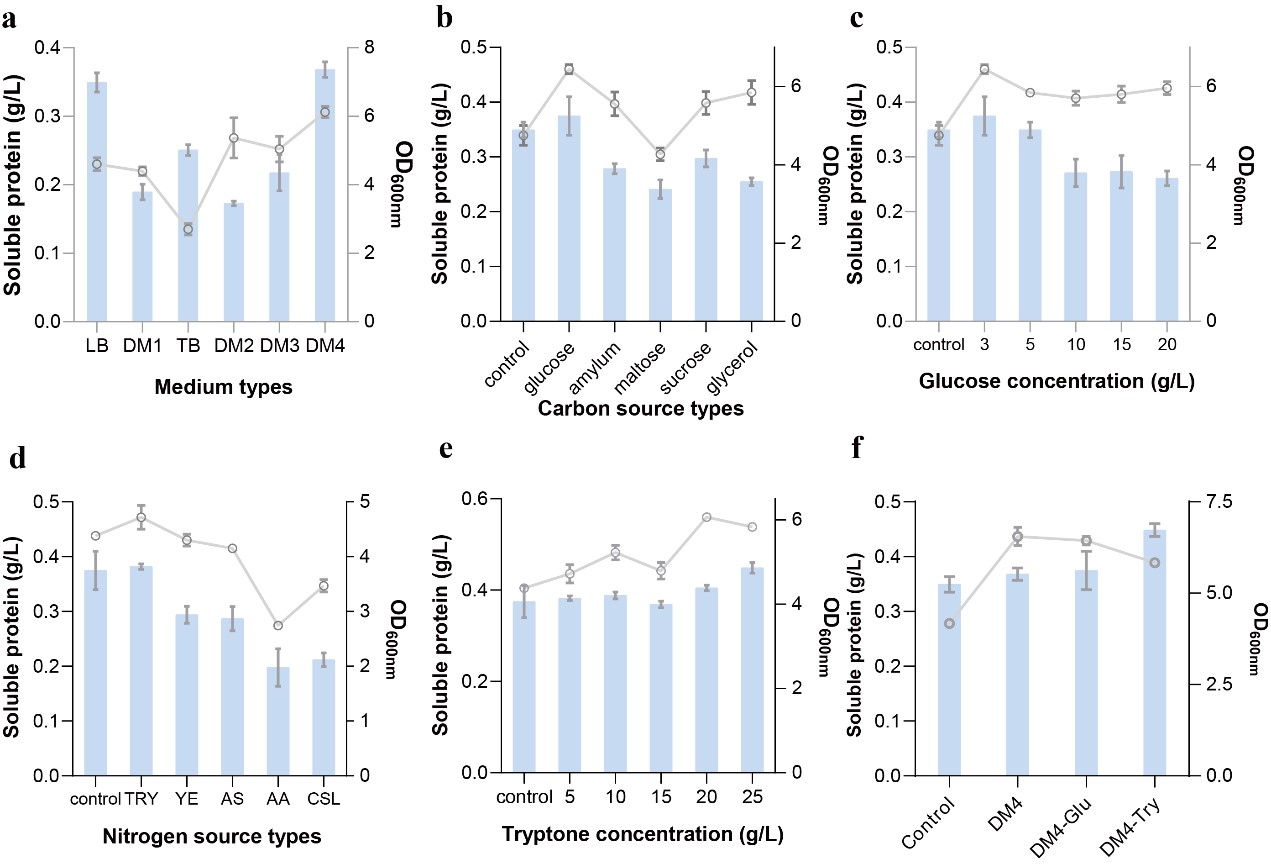
基础培养基碳/氮源优化以恢复细胞生长和蛋白生产能力
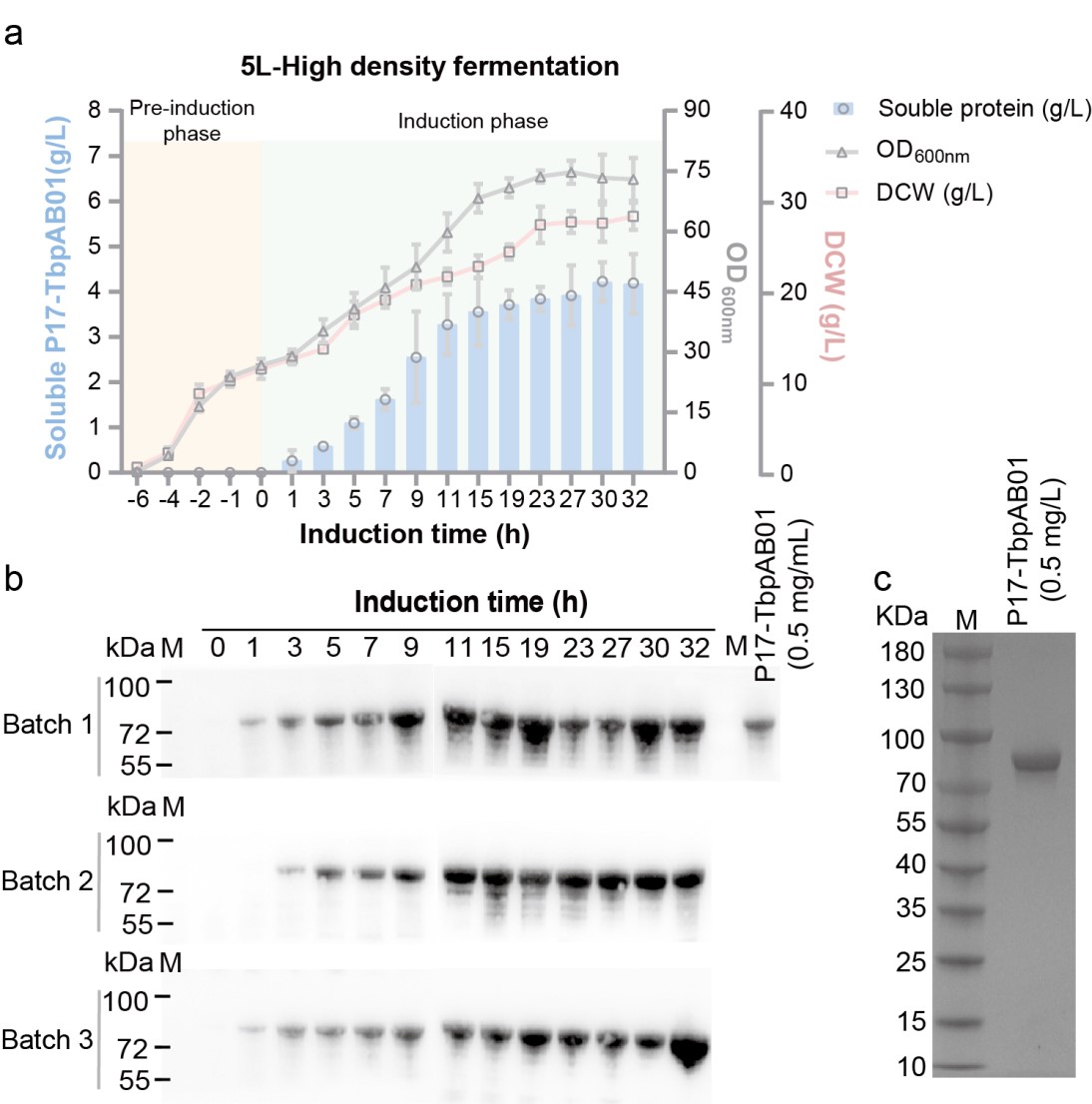
嵌合抗原生产菌株的高细胞密度发酵


